小血管损伤后血液将从血管流出,但在正常人,数分钟后出血将自行停止,称为生理止血。用一个小撞针或注射针刺破耳垂或指尖使血液流出,然后测定出血延续的时间,这一段时间称为出血时间(bleeding time)。出血时间的长短可以反映生理止血功能的状态。正常出血时间为1-3分钟。血小板减少,出血时间即相应延长,这说明血小板在生理止血过程中有重要作用;但是血浆中一些蛋白质因子所完成的血液凝固过程也十分重要。凝血有缺陷时常可出血不止。
生理止血过程包括三部分功能活动。首先是小血管于受伤后立即收缩,若破损不大即可使血管封闭;主要是由损伤刺激引起的局部缩血管反应,但持续时间很短。其次,更重要的是血管内膜损伤,内膜下组织暴露,可以激活血小板和血浆中的凝血系统;由于血管收缩使血流暂停或减缓,有利于激活的血小板粘附于内膜下组织并聚集成团,成为一个松软的止血栓以填塞伤口。接着,在局部又迅速出现血凝块,即血浆中可溶的纤维蛋白源转变成不溶的纤维蛋白分子多聚体,并形成了由血纤维与血小板一道构成的牢固的止血栓,有效地制止了出血。与此同时,血浆中也出现了生理的抗凝血活动与纤维蛋白溶解活性,以防止血凝块不断增大和凝血过程漫延到这一局部以外。显然,生理止血主要由血小板和某些血浆成分共同完成。
一、血凝、抗凝与纤维蛋白溶解
血液离开血管数分钟后,血液就由流动的溶胶状态变成不能流动的胶冻状凝块,这一过程称为血液凝固(blood coagulation)或血凝。在凝血过程中,血浆中的纤维蛋白源转变为不溶的血纤维。血纤维交织成网,将很多血细胞网罗在内,形成血凝块。血液凝固后1-2小时,血凝块又发生回缩,并释出淡黄色的液体,称为血清。血清与血浆的区别,在于前者缺乏纤维蛋白原和少量参与血凝的其他血浆蛋白质,但又增添了少量血凝时由血小板释放出来的物质。
血浆内具备了发生凝血的各种物质,所以将血液抽出放置于玻璃管内即可凝血。血浆内又有防止血液凝固的物质,称为抗凝物质(anticoagulant)。血液在血管内能保持流动,除其他原因外,抗凝物质起了重要的作用。血管内又存在一些物质可使血纤维再分解,这些物质构成纤维蛋白溶解系统(简称纤溶系统)(fibrinloytic system)。
在生理止血中,血凝、抗凝与纤维蛋白溶解相互配合,既有效地防止了失血,又保持了血管内血流畅通。
(一)血液凝固
凝血因子血浆与组织中直接参与凝血的物质,统称为凝血因子(bloodclotting factors),其中已按国际命名法用罗马数字编了号的有12种(表3-4)。此外,还有前激肽释放酶、高分子激肽原以及来自血小板的磷脂等直接参与凝血过程。除因子Ⅳ与磷脂外,其余已知的凝血因子都是蛋白质,而且因子Ⅱ、Ⅶ、Ⅸ、Ⅹ、Ⅺ、Ⅻ以及前激肽释放酶都是蛋白酶。这些蛋白酶都属于内切酶,即每一种酶只能水解某两种氨基酸所形成的肽键。因而不能将某一知肽链分解成很多氨基酸,而只能是对某一条肽链进行有限的水解。通常在血液中,因Ⅱ、Ⅶ、Ⅸ、Ⅹ、Ⅺ、Ⅻ都是无活性的酶原,必须通过有限水解在其肽链上一定部位切断或切下一个片段,以暴露或形成活性中心,这些因子才成为有活性的酶,这个过程称为激活。被激活的酶,称为这些因子的“活性型”,习惯上于该因子代号的右下角加一“a”字来表示。如凝血酶原被激活为凝血酶,即由因子Ⅱ变成因子Ⅱa。因子Ⅶ是以活性型存在于血液中的,但必须有因子Ⅲ(即组织凝血激酶)同时存在才能起作用,而在正常时因子Ⅲ只存在于血管外,所以通常因子Ⅶ在血流中也不起作用。
表3-4 按国际命名法编号的凝血因子
编 号同 义 名因子Ⅰ纤维蛋白原(fibrinogen)因子Ⅱ凝血酶原(prothrombin)因子Ⅲ组织凝血激素(tissue thromboplastin)因子ⅣCa2+因子Ⅴ前加速素(proaccelerin)因子Ⅶ前转变素(proconvertin)因子Ⅷ抗血友病因子(antihemophilic factor,AHF)因子Ⅸ血浆凝血激酶(plasma thromboplastin component,PTC)因子ⅩStuart-Prower因子因子Ⅺ血浆凝血激酶前质(plasma thromboplastin antecedent,PTA)因子Ⅻ接触因子(contact factor)因子ⅩⅢ纤维蛋白稳定因子(fibrin-stabilizing factor)
凝血过程凝血过程基本上是一系列蛋白质有限水解的过程,凝血过程一旦开始,各个凝血因子便一个激活另一个,形成一个“瀑布”样的反应链直至血液凝固。凝血过程大体
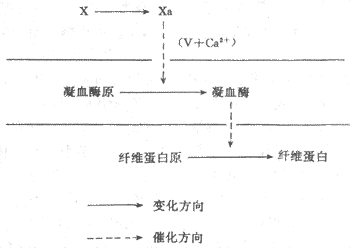
图3-4凝血过程的三个阶段简图
上可分为三个阶段(图3-4):即因子χ激活成χa;因子Ⅱ(凝血酶原)激活成Ⅱa(凝血酶);因子Ⅰ(纤维蛋白原)转变成Ⅰa(纤维蛋白)。
因子χ的激活可以通过两种途径。如果只是损伤血管内膜或抽出血液置于玻璃管内,完全依靠血浆内的凝血因子逐步使因子χ激活从而发生凝血的,称为径内源性激活途径(intrinsic route);如果是依靠血管外组织释放的因子Ⅲ来参与因子χ的激活的,称为外源性激活途径(extrinxic route),如创伤出血后发生凝血的情况。
1.内源性途径一般从因子Ⅻ的激活开始。血管内膜下组织,特别是胶原纤维,与因子Ⅻ接触,可使因子Ⅻ激活成Ⅻa。Ⅻa可激活前激肽释放酶使之成为激肽释放酶;后者反过来又能激活因子Ⅻ,这是一种正反馈,可使因子Ⅻa大量生成。Ⅻa又激活因子Ⅺ成为Ⅺa。由因子Ⅻ激活到Ⅺa形成为止的步骤,称为表面激活。表面激活过程还需有高分子激肽原*参与,但其作用机制尚不清楚。表面激活所形成的Ⅺa再激活因子Ⅸ生成Ⅸa,这一步需要有Ca2+(即因子Ⅳ)存在。Ⅸa再与因子Ⅷ和血小板3因子(PF3)及Ca2+组成因子Ⅷ复合物,即可激活因子Χ生成Χa。血小板3因子可能就是血小板膜上的磷脂,它的作用主要是提供一个磷脂的吸附表面。因子Ⅸa和因子χ分别通过Ca2+而同时连接于这个磷脂表面,这样,因子Ⅸa即可使因子χ发生有限水解而激活成为χa。但这一激活过程进行很缓慢,除非是有因子Ⅷ参与。因子Ⅷ本身不是蛋白酶,不能激活因子х,但能使Ⅸa激活因子χ的作用加快几百倍。所以因子Ⅷ虽是一种辅助因子,但是十分重要。遗传性缺乏因子Ⅷ将发生甲型血友病(hemophilia A),这时凝血过程非常慢,甚至微小的创伤也出血不止。先天性缺乏因子Ⅸ时,内源性途径激活因子χ的反应受阻,血液也就不易凝固,这种凝血缺陷称为B型血友病(hemophilia B)。
2.外源性途径由因子Ⅶ与因子Ⅲ组成复合物,在有Ca2+存在的情况下,激活因子χ生成χa。因子Ⅲ,原名组织凝血激酶,广泛存在于血管外组织中,但在脑、肺和胎盘组织中特别丰富。因子Ⅲ为磷脂蛋白质。Ca2+的作用就是将因子Ⅶ与因子χ都结合于因子Ⅲ所提供的磷脂上,以便因子Ⅶ催化因子χ的有限水解,形成χa。
Χa又与因子Ⅴ、PE3和Ca2+形成凝血酶原酶复合物,激活凝血酶原(因子Ⅱ)生成凝血酶(Ⅱa)。在凝血酶原酶复合物中的PF3也是提供磷脂表面,因子Χa和凝血酶原(因子Ⅱ)通过Ca2+而同时连接于磷脂表面,χa催化凝血酶原进行有限水解,成为凝血酶(Ⅱa)。因子Ⅴ也是辅助因子,它本身不是蛋白酶,不能催化凝血酶原的有限水解,但可使χa的作用增快几十倍。
因子χ与凝血酶原的激活,都是在PF3提供的磷脂表面上进行的,可以将这两个步骤总称为磷脂表面阶段。在这一阶段中,因子Ⅱ(凝血酶原)、因子Ⅶ、因子Ⅸ和因子χ,都必须通过Ca2+连接于磷脂表面。因此,在这些因子的分子上必须有能与Ca2+结合的部位。现已知,因子Ⅱ、Ⅶ、Ⅸ、х都是在肝中合成。这些因子在肝细胞的核糖体处合成肽链后,还需依靠维生素K的参与,使肽链上某些谷氨酸残基于γ位羧化成为γ-羧谷氨酸残基,构成这些因子的Ca2+结合部位。因此,缺陷维生素K,将出现出血倾向。
凝血酶(thrombin)有多方面的作用。它可以加速因子Ⅶ复合物与凝血酶原酶复合物的形成并增加其作用,这也是正反馈;它又能激活因子ⅩⅢ生成ⅩⅢa;但它的主要作用是催化纤维蛋白原的分解,使每一分子纤维蛋白原从N-端脱下四段小肽,转变成为纤维蛋白单体(fibrin monomer),然后互相连接,特别是在ⅩⅢa作用下形成牢固的纤维蛋白多聚体(fibrin polymers),即不溶于水的血纤维。上述凝血过程可见图3-5表示。
一般来说,通过外源性途径凝血较快,内源性途径较慢,但在实际情况中,单纯由一种途径引起凝血的情况不多。
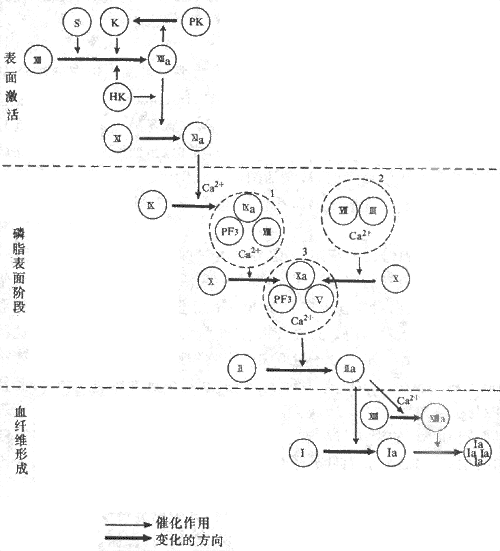
图3-5血液凝固过程示意图
S;血管内皮下组织 PF3:血小板3因子PK:前激肽释放酶 1:因子Ⅷ复合物
K:激肽释放酶 2:因子Ⅶ复合物 HK:高分子激肽原 3:凝血酶原酶复合物
在凝血的某些阶段,内源性途径与外源性途径之间存在着功能的交叉,也就是说,这两条途径之间具有某些“变通”的途径。例如,外源性的因子Ⅶa和Ⅲ可以形成复合物直接激活因子Ⅸ,从而部分代替了因子Ⅺ和Ⅻa的功能。这一机制得以解释为什么在因子Ⅸ缺乏时的出血倾向,较因子Ⅺ和Ⅻ缺乏时更为严重。另一方面,内源性因子Ⅻ的裂解产物和因子Ⅸa也能激活外源性的因子Ⅶ。
(二)抗凝系统的作用
正常人1ml血浆含凝血酶原约300单位,在凝血时通常可以全部激活。10ml血浆在凝血时生成的凝血酶就足以使全身血液凝固。但在生理止血时,凝血只限于某一小段血管,而且1ml血浆中出现的凝血酶活性很少超出8-10单位,说明正常人血浆中有很强的抗凝血酶活性。
现在已经查明,血浆中最重要的抗凝物质是抗凝血酶Ⅲ(antithrombinⅢ)和肝素,它们的作用约占血浆全部抗凝血酶活性的75%。抗凝血酶Ⅲ是血浆中一种丝氨酸蛋白酶抑制物(serine protease inhibitor)。因子 Ⅱa、Ⅶ、Ⅸa、χa、Ⅻa的活性中心均含有丝氨酸残基,都属于丝氨酸蛋白酶(serine protease)。抗凝血酶Ⅲ分子上的精氨酸残基,可以与这些酶活性中心的丝氨酸残基结合,这样就“封闭”了这些酶的活性中心而使之失活。在血液中,每一分子抗凝血酶Ⅲ,可以与一分子凝血酶结合形成复合物,从而使凝血酶失活。
肝素是一种酸性粘多糖,主要由肥大细胞和嗜碱性粒细胞产生,存在于大多数组织中,在肝、肺、心和肌组织中更为丰富。
肝素在体内和体外都具有抗凝作用,肝素抗凝的主要机制在于它能结合血浆中的一些抗凝蛋白,如抗凝血酶Ⅲ和肝素辅助因子Ⅱ(heparincofactorⅡ)等,使这些抗凝蛋白的活性大为增强。当肝素与抗凝血酶Ⅱ的某一个ε-氨基赖氨酸残基结合,则抗凝血酶Ⅲ与凝血酶的亲和力可增强100倍,使两者结合得更快,更稳定,使凝血酶立即失活。当肝素与肝素辅助因子Ⅱ结合而激活后者时,被激活的肝素辅助因子Ⅱ特异性地与凝血酶结合成复合物,从而使凝血酶失活,在肝素的激活作用下,肝素辅助因子灭活凝血酶的速度可以加快约1000倍。
肝素还可以作用血管内皮细胞,使之释放凝血抑制物和纤溶酶原激活物,从而增强对凝血的抑制和纤维蛋白的溶解。此外,肝素能激活血浆中的脂酶,加速血浆中乳糜微粒的清除,因而减轻脂蛋白对血管内皮的损伤,有助于防止与血脂有关的血栓形成。
天然肝素是一种分子量不均一的混合物,分子量为3000-57000不等。这种不均一是生物合成过程有差异所致。不同分子量肝素的生物作用也不完全相同。一般将分子量在7000以下肝素称为低分子量肝素。低分子量肝素只与抗凝血酶Ⅱ结合,而分子量较大的肝素除了能与抗凝血酶Ⅲ结合外,还能与血小板结合,结果不仅抑制血小板表面凝血酶的形成,而且抑制血小板的聚集与释放。由于分子量较大的肝素抗凝作用的环节较多,作用较为复杂,易引起出血倾向,而低分子时肝素具有半衰期较长,抗凝效果好和引起出血倾向少等优点,因而更适于作为外源性抗凝剂。
从化学本质看,凝血过程是一系列酶促反应链,其中主链是一系列丝氨酸蛋白酶的作用。组成抗凝系统的一类物质是血浆中存在的多种丝氨酸蛋白酶抑制物。上述抗凝血酶Ⅲ是其中最为重要的一种。属于丝氨酸蛋白酶抑制物的抗凝物质还有能抑制补体第1成分和因子Ⅻa、Ⅺa、的C1抑制物(C1inhibitor),广谱的蛋白酶抑制物a2-巨球蛋白(a2-macroglobulin)等。抗凝系统中的另一类物质是辅因子抑制物,这类抑制物通过对凝血辅因子如因子Ⅴ和Ⅷ活性的抑制而实现抗凝作用。下述的蛋白质C和凝血酶调制素都是属于这类抗凝物质。
蛋白质 C(proteinC)是近年来引起注意的另一种具有抗凝作用的血浆蛋白,分子量为62000,它由肝合成,并有赖于维生素K的存在。蛋白质C以酶原形式存在于血浆中,蛋白质C在凝血酶的作用下发生有限的酶解过程,从分子上裂解下一个小肽后即具有活性。激活的蛋白质C与血管内皮表面存在的辅因子凝血酶调制素(thrombomodulin)结合成复合物,在Ca2+存在的条件下这种复合物使蛋白质C的激活过程大大加快。激活的蛋白质C具有多方面的抗凝血、抗血栓功能,主要的作用包括:①灭活凝血因子Ⅴ和Ⅷ。这种灭活也是一种酶解过程,即是把因子Ⅴ和Ⅷ的重链进行水解,使他们与磷脂的结合力降低。这种灭活反应需要有Ca2+的存在,反应的速度是很快的;②限制因子Χa与血小板结合。存在于血小板表面的因子Ⅴa是因子Χa的受体。当因子Χa与这种受体结合后,可使因子Χa的活性大为增强。由于激活的蛋白质C能使因子Ⅴa灭活,使因子Χa与血小板的结合受到阻碍,结果可使因子Χa激活凝血酶原的作用大为减弱;③增强纤维蛋白的溶解。激活的蛋白质C能刺激溶酶原激活物的释放,从而增强纤溶活性。激活的蛋白质C的这一作用只有在内皮细胞存在的情况下才能实现。维生素K缺乏或患肝病可使蛋白质C的合成减少;某些病理情况造成血管内皮广泛损伤时使凝血酶调制减少,这种减少转而使蛋白质C的激活受阻。不论是蛋白质C减少或活化受阻都增加了形成血栓的倾向。
体外延缓或阻止血液凝固的因素:①降低温度,当反应系统的温度降低至10℃以下时,很多参与凝血过程的酶的活性下降,因些可延缓血液凝固,但不能完全阻止凝血的发生;②光滑的表面,也称不湿表面,可减少血小板的聚集和解体,减弱对凝血过程的触发,因而延缓了凝血酶的形成。例如,将血液盛放在内表面涂有硅胶或石蜡的容器内,即可延缓血凝,③去Ca2+,由于血液凝固的多个环节中都需要Ca2+的参加,因此如在体外向血液中加入某些能与钙结合形成不易解离但可溶解的络合物,从而减少了血浆中的Ca2+,防止了血液凝固。由于少量枸橼酸钠进入血液循环不致产生毒性,因此常用它作抗凝剂来处理输血用的血液。此外,实验室中可使用草酸铵、草酸钾和螯合剂乙二胺四乙酸(ECTA)作抗凝剂,它们能与Ca2+结合不易溶解的复合物。但它们对机体有害,因而不能进入体内。
(三)纤维蛋白溶解
在生理止血过程中,小血管内的血凝块常可成为血栓,填塞了这一段血管。出血停止、血管创伤愈合后,构成血栓的血纤维可逐渐溶解,先形成一些穿过血栓的通道,最后可以达到基本畅通。血纤维溶解的过程,称为纤维蛋白溶解(简称纤溶)。
纤维蛋白溶解(纤溶)系统包括四种成分,即纤维蛋白溶解酶原(plasminogen)(纤溶酶原,血浆素原)、纤维蛋白溶解酶(plasmin)(纤溶酶,血浆素)、纤溶原激活物与纤溶抑制物。纤溶的基本过程可分两个阶段,即纤溶酶原的激活与纤维蛋白(或纤维蛋白原)的降解(图3-6)。
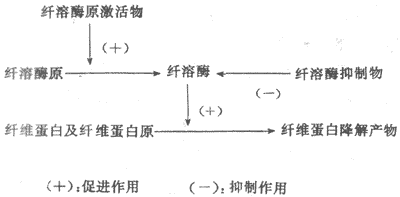
图3-6纤维蛋白溶解系统
1.纤溶酶原激活纤溶酶原很可能是在肝、骨髓、嗜酸性粒细胞与肾中合成的;在正常成年人每100ml血浆中约含10-20mg纤溶酶原,婴儿较少,妇女晚期妊娠时增多。
纤溶酶原激活物分布广而种类多,主要有三类:第一类为血管激活物,在小血管内皮细胞中合成后释放于血中,以维持血浆内激活物浓度于基本水平。血管内出现血纤维凝块时,可使内皮细胞释放大量激活物。所释放的激活物大都吸附于血纤维凝块上,进入血流的很少。肌肉运动、静脉阻断、儿茶酚胺与组胺等也可使血管内皮细胞合成和释放的激活物增多。第二类为组织激活物,存在于很多组织中,主要是在组织修复、伤口愈合等情况下,在血管外促进纤溶。肾合成与分泌的尿激酶就属于这一类激活物,活性很强,有助于防止肾小管中纤维蛋白沉着。第三类为依赖于因子Ⅻ的激活物,例如前激肽释放酶被Ⅻa激活后,所生成的激肽释放酶即可激活纤溶酶原。这一类激活物可能使血凝与纤溶互相配合并保持平衡。
血浆中的激活物的半衰期约13分钟,通常迅速被肝清除。
纤溶酶原的激活也是有限水解的过程,在激活物的作用下,脱下一段肽链成为纤溶酶。
2.纤维蛋白(与纤维蛋白原)的降解 纤溶酶和凝血酶一样,也是蛋白酶,但是它对纤维蛋白原的作用与凝血酶不同。凝血酶只是使纤维蛋白原从其中两对肽链的N-端各脱下一个小肽,使纤维蛋白原转变成纤维蛋白。纤溶酶却是水解肽链上各单位的赖氨酸-精氨酸键,从而逐步将整个纤维蛋白或纤维蛋白原分割成很多可溶的小肽,总称为纤维蛋白降解产物。纤维蛋白降解产物一般不能再出现凝固,而且其中一部分有抗血凝的作用。
纤溶酶是血浆中活性最强的蛋白酶,但特异性较小,可以水解凝血酶、因子Ⅴ、因子Ⅷ、激活因子Ⅻa;促使血小板聚集和释放5-羟色胺、ADP等;还能激活血浆中的补体系统;但它的主要作用是水解纤维蛋白原和纤维蛋白。血管内出现血栓时,纤溶主要局限于血栓,这可能是由于血浆中有大量抗纤溶物质(即抑制物)存在,而血栓中的纤维蛋白却可吸附或结合较多的激活物所致。正常情况下,血管内膜表面经常有低水平的纤溶活动,很可能血管内也经常有低水平的凝血过程,两者处于平衡状态。
3.抑制物及其作用血液中存在的纤溶抑制物主要是抗纤溶酶(antiplasmin) ,但其特异性不大,例如,a2-巨球蛋白能普遍抑制各种内切酶,包括纤溶酶、胰蛋白酶、凝血酶、激肽释放酶等。每一分子a2-巨球蛋白可结合一分子纤溶酶,然后迅速被吞噬细胞清除。血浆中a1-抗胰蛋白酶也对纤溶酶有抑制作用,但作用较慢,然而它分子量小,可渗出血管,控制血管外纤溶活动。看来这些抑制物的作用,是广泛控制在血凝与纤溶两个过程中起作用的一些酶类。这对于将血凝与纤溶局限于创伤部位,有重要意义。
(四)表面激活与血液的其他防卫功能
血管损伤后暴露出内膜下组织,通过表面激活使因子Ⅻ激活成因子Ⅻa,因子Ⅻa 又激活肽释放酶成为激肽释放酶,而激肽释放酶又可激活因子Ⅻ,从而形成一个正反馈环,可形成足够的Ⅻa 和激肽释放酶。这样,不但同时激活了血凝和纤溶系统,也激活了补体系统和激肽系统(图3-7)。补体激活的一些产物和激肽都是作用很强的趋化因子,能吸收吞噬细胞到受损伤的部位,产生非特异性免疫反应;这样使生理止血功能与免疫功能相配合,有效的保护机体,减少创伤带来的损害。
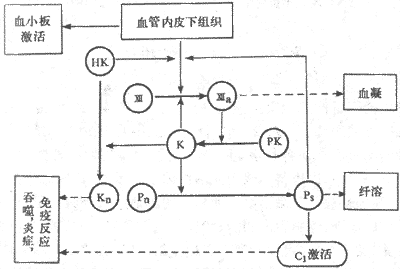
图3-7表面激活也血液各种防卫功能关系示意图
PK:前激肽释放酶 Pn:纤溶酶原 K:激肽释放酶 Pn:纤溶酶
HK:高分子激肽原 CI:补体 Kn:激肽 Ⅻ与Ⅻa,因子Ⅻ及其激活型
二、血小板的止血功能
因血管创伤而失血时,血小板在生理止血过程中的功能活动大致可以分为两段,第一段主要是创伤发生后,血小板迅速粘附于创伤处,并聚集成团,形成较松软的止血栓子;第二段主要是促进血凝并形成坚实的止血栓子。
(一)血小板粘附与聚集
止血中较松软的血小板止血栓子的形成,要经过血小板粘附与聚集两个过程。
血管损伤后,流经此血管的血小板被血管内皮下组织表面激活,立即粘附于损伤处暴露的胶原纤维上。参与血小板粘附过程的主要因素包括:血小板膜糖蛋白I(GPI)、vonWillebrand因子(vW因子)和内皮下组织中的胶原。当血小板缺乏GPI或胶原纤维变性时,血小板粘附(thrombocyte adhesion)功能便受损。发生血小板粘附过程的可能机制是vW因子再与血小板膜上的特异受体结合。此外,血小板膜上的糖苷移换酶活性和胶原蛋白分子的构型与粘附也有着密切关系。
粘附主要是一种表面现象,粘附一旦发生了,血小板的聚集过程(thrombocyteaggregation)也随即发生。聚集是指一些血小板相互粘连在一起的过程。聚集开始时,血小板由圆盘形变成球形,并伸出一些貌似小刺的伪足;同时血小板脱粒,即原来贮存于致密颗粒内的ADP、5-羟色胺等活性物质被释放。ADP释放和某些前列腺素的生成,对聚集的引起十分重要。
1.ADP的作用 在体外实验中看到,ADP是使血小板聚集最重要的物质,特别是从血小板释放出来的这种内源性ADP尤其重要。在血小板悬液中加入小量ADP(浓度在0.9μmol/L以下),能迅速引起血小板聚集,但很快又解聚;若加入中等剂量的ADP(1.0μmol/L左右),则在第一聚集时相结束和解聚后不久,又出现第二个不可逆的聚集时相,这是由于血小板释放的内源性ADP所引起的;若是加入大量ADP,则迅速引起不可逆的聚集,即直接进入聚集的第二时相.以不同剂量的凝血酶加入血小板悬液,也可使血小板发生聚集;而且与ADP相似,随着加入剂量的逐渐增加,可看到从只有第一时相可逆性聚集,到出现两个时相的聚集,再到直接进入第二时相的聚集.因为,用腺苷阻断内源性ADP的释放或用腺苷三磷酸双磷酸酶(apyrase)以破坏ADP,均可抑制凝血酶引起的聚集,说明凝血酶的作用可能是由于凝血酶与血小板细胞膜上的凝血酶受体结合后,引起内源性ADP释放所引起的。加入胶原也可引进悬液中的血小板聚集,然而只有第二时相的不可逆聚集,一般认为这也是由于胶原引起内源性的ADP释放所致。
一般能引起血小板聚集的物质均可使血小板内cAMP减少,而抑制血小板聚集的则使cAMP增多。因而目前认为,可能是cAMP减少引起血小板内Ca2+增加,促使内源性ADP释放。
ADP引起血小板聚集,还必须有Ca2+和纤维蛋白原存在,而且要消耗能量。将血小板悬浮于缺乏葡萄糖的溶液中数小时,或用药物阻断或减弱血小板产生ATP的代谢过程,均将抑制血小板的聚集。ADP也不能使洗净了的血小板聚集,除非加入纤维蛋白原;但凝血酶和胶原可使洗净了的血小板聚集。因为在这种情况下,可使血小板a 颗粒内的纤维蛋白原释放。
ADP是通过血小板膜上的ADP受体引起聚集的。目前认为,血小板膜上有表面ATP酶,这是防止血小板相互粘聚所必需的,而ADP可抑制表面ATP酶的活性;ADP还可使血小板暴露出磷脂表面,因而可以通过Ca2+“搭桥”而互相粘聚。
2.血小板前列腺素类物质的作用血小板质膜的磷脂中含有花生四烯酸,血小板细胞内有磷脂酸A2。在血小板被表面激活时,磷脂酶A2也被激活。在磷脂酶A2的催化作用下,花生四烯酸从质膜的磷脂中分离出来。花生四烯酸在血小板的环氧化酶作用下,产生前列腺素G2和H2 (PGG2、PGH2)。PGG2和PGH2都是环内过氧化物,有很强的引起血小板聚集的作用。但是PGG2和PGH2都很不稳定,可以直接生成小量PGE2和PGF2。PGH2可以在血栓素合成酶的催化作用下,形成大量血栓素A2(thromboxane A2,TXA2)。TXA2 使血小板内cAMP减少,因而有很强的聚集血小板的作用,也有很强的收缩血管的作用。TXA2也不稳定迅速转变成无活性的血栓素B2(TXB2)。咪唑(imidazole)可抑制血栓素合成酶,所以有防止血小板聚集的作用。此外,正常血管壁内皮细胞中有前列腺环素合成酶,可以催化血小板生成的PGH2 生成前列腺环素(prostacyclin,PGI2)。PGI2可使血小板内cAMP增多,因而有很强抑制血小板聚集的作用,也有很强的抑制血管收缩的作用。PGI2也很不稳定,迅速变成无活性的6-酮-PGF1a。关于由花生四烯酸衍变成TXA2与PGI2的过程可参看图3-8。
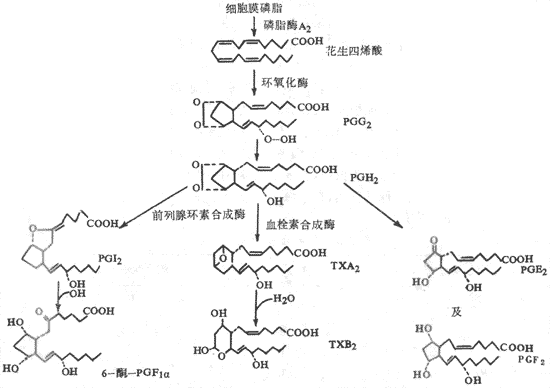
图3-8血小板前列腺素与血栓素的合成
在发现TXA2和PGI2之后,曾设想在正常情况下可能是血管壁的PGI2与血小板的TXA2之间保持了平衡,因而使血小板不致聚集。可以设想,血管损伤暴露内皮下组织时,一方面激活血小板和激活内源性凝血途径,损坏的血管组织释放凝血因子Ⅲ又激活外源性凝血途径,于是在此局部迅速形成凝血酶;另一方面血管损伤使局部血管壁PGI2减少。这样,由此血管通过的血小板即粘附于损伤处的胶原纤维上,随即血小板也发生变形、聚集,并激活磷脂酶A2,导致合成TXA2,TXA2可使血小板内cAMP减少而游离Ca2+增多,以致血小板脱粒释放内源性ADP,又使更多的血小板聚集,迅速形成松软的止血栓子。
(二)血小板与凝血
血小板对于血液凝固有重要的促进作用,如将血液置于管壁涂一薄层硅胶的玻璃管中,使血小板不易解体,虽然未加入任何抗凝剂,血液可保持液态达72小时以上;若加入血小板匀浆则立即发生凝血。这说明血小板破裂后的产物对于凝血过程有很强的促进作用。
血小板表面的质膜结合有多种凝血因子,如纤维蛋白原、因子Ⅴ、因子Ⅺ、因子ⅩⅢ等。a-颗粒中也含有纤维蛋白原、因子因子ⅩⅢ和一些血小板因子(PE),其中PF2和PF3都是促进血凝的。PF4可中和肝素,PF6则抑制纤溶。当血小板经表面激活后,它能加速凝血因子Ⅻ和Ⅺ的表面激活过程。血小板所提供的磷脂表面(PF3),据估计可使凝血酶原的激活加快两万倍。因子Ⅹa和因子Ⅴ连接于此磷脂表面后,还可以免受抗凝血酶Ⅲ和肝素对它们的抑制作用。
当血小板聚集形成止血栓时,凝血过程已在此局部进行,血小板已暴露大量磷脂表面,为因子Ⅹ和凝血酶原的激活提供了极为有利的条件。血小板聚集后,其α颗粒中的各种血小板因子释放出来,促进血纤维的形成和增多,并网罗其它血细胞形成凝块。因而血小板虽逐渐解体,止血栓子仍可增大。血凝块中留下的血小板有伪足伸入血纤维网中,这些血小板中的收缩蛋白收缩,使血凝块回缩,挤压出其中的血清而成为坚实的止血栓,牢牢地封住血管缺口。
在表面激活血小板和血凝系统时,同时也激活了纤溶系统。血小板内所含的纤溶酶及其激活物将释放出来。血纤维和血小板释放的5-羟色胺等,也能使内皮细胞释放激活物。但是由于血小板解体,同时释放出PF6和另一些抑制蛋白酶的物质,所以在形成血栓时,不致受到纤溶活动的干扰。
本文传播知识,如有侵权,请联系微信tunyi13166124885;本文非处方,如需治病,请联系医院。

